Анализ in silico взаимодействия биологически активных компонентов морских водорослей с рядом белков-мишеней антидиабетических средств
1Centre for Bio-computing and Drug Development, Adekunle Ajasin University, Akungba-Akoko, Ondo State, Nigeria; *e-mail: tomisin.ogunwa@aaua.edu.ng
2Department of Biochemistry, Adekunle Ajasin University, Akungba-Akoko, Ondo State, Nigeria
3Department of Animal and Environmental Biology, Adekunle Ajasin University, Akungba-Akoko, Ondo State, Nigeria
4Department of Biochemistry, University of Ibadan, Ibadan, Oyo State, Nigeria
Ключевые слова: протеин-тирозинфосфатаза 1В; компоненты водорослей; диабет; докинг; α-глюкозидаза
DOI:10.18097/BMCRM00074
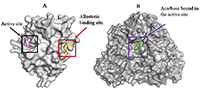
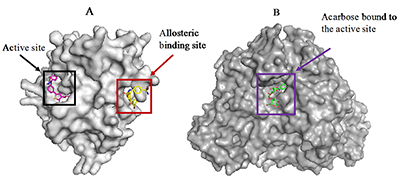
Морские водоросли оказывают положительный эффект при лечении сахарного диабета. Из водорослевого сырья был выделен ряд соединений, предположительно обладающих биологической активностью. Данное исследование направлено на уточнение возможного механизма связывания и ингибиторного действия соединений, полученных из морских водорослей, на ферменты протеин-тирозинфосфатазу 1В (РТР1В), который играет ключевую роль в формировании резистентности к инсулину, и α-глюкозидазу, участвующую в гидролизе углеводов после приема пищи. Ингибиторы данных ферментов могут быть использованы при лечении сахарного диабета второго типа. Экспериментами по молекулярному докингу показано, что антидиабетические соединения, как правило, связываются с молекулой белка PTP1B аллостерически, равноудаленно от спиралей α3, α6 и α7. Величина изменения свободной энергии ∆G комплекса при этом предпочтительнее, чем при связывании в активном центре. Пространственное положение для соединений экол, диэкол, 7-флороэкол и флорофукофуроэкол-А соответствовало положению референсного лиганда. При связывании с активным центром α-глюкозидазы данные соединения, напротив, проявляли заметное сродство к активному центру фермента. Флорофукофуроэкол-А, диэкол, а также экол продемонстрировали более высокий потенциал ингибирования ферментов по сравнению c акарбозой. Возможно, это обусловлено большим размером молекулы и увеличением количества гидроксильных групп, а также дополнительными гидрофобными и π-π взаимодействиями, которые отсутствуют в комплексе акарбозы с α-глюкозидазой. Данные по аффинности соединений, полученные в данной работе, хорошо коррелируют с экспериментальными данными для обоих белков. Спектр описанных взаимодействий играет ключевую роль в понимании механизмов, отвечающих за антидиабетическую активность морских водорослей.
|
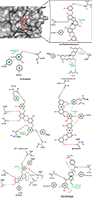
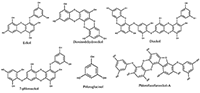
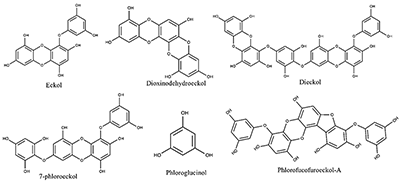
Рисунок 3.
Химическая структура биологически активных соединений, полученных из водорослей и изучаемых в рамках данного исследования.
|
|
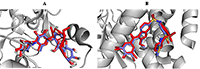
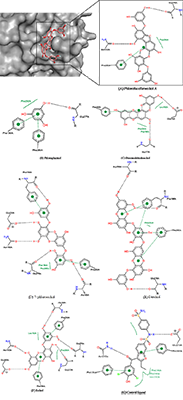
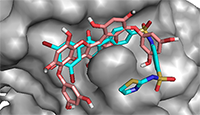
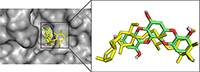
Рисунок 4.
Сравнение положения молекул контрольного лиганда (голубой) и флорофукофуроэкола-А (розовый) в предполагаемом аллостерическом сайте связывания молекулы белка PTP1B.
|
|
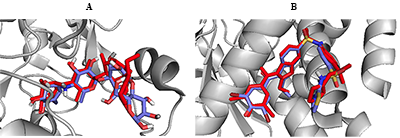
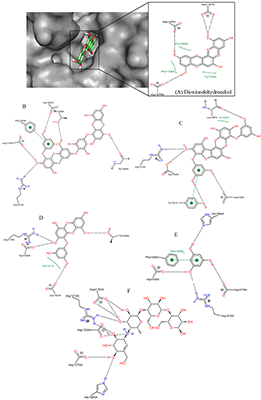
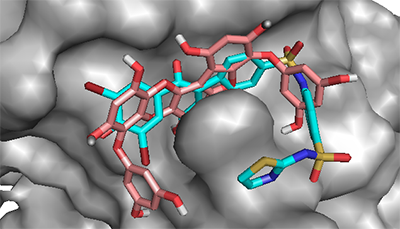
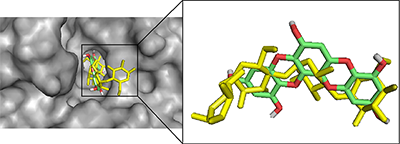
Рисунок 6.
Сравнение положения молекул при связывании в активном центре α-глюкозидазы (диоксинодегидроэкол – зеленый, референсный лиганд акарбоза - желтый).
|
|
ЗАКРЫТЬ

|
Таблица 1.
Сравнение энергии связывания биологически активных компонентов морских водорослей при связывании в активном центре и аллостерическом центре белка PTP1B.
|
|
ЗАКРЫТЬ

|
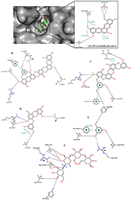
Таблица 2.
Анализ межмолекулярных взаимодействий биологически активных компонентов морских водорослей при аллостерическом связывании с молекулой белка PTP1B.
|
|
ЗАКРЫТЬ

|
Таблица 3.
Анализ межмолекулярных взаимодействий компонентов водорослей в активном центре α-глюкозидазы.
|
БЛАГОДАРНОСТИ
Мы хотим выразить благодарность сотрудникам технической поддержки, а также всем исследователям из Centre for Bio-computing and Drug Development (CBDD), Adekunle Ajasin University, Akungba-Akoko, Ondo state, Nigeria.
ЛИТЕРАТУРА
- Blair, M. (2016) Diabetes Mellitus Review. Urol Nurs. 36(1), 27-36. DOI
- Kharroubi, A.T. & Darwish. H.M. (2015) Diabetes mellitus: The epidemic of the century. World J Diabetes. 6(6), 850-67. DOI
- Lee, J.Y., Jung, K.W., Woo, E.R. & Kim, Y. (2008) Docking study of biflavonoids, allosteric inhibitors of protein tyrosine phosphatase 1B. Bull. Korean Chem. Soc. 29, 1479-1484. DOI
- Shinde, R.N., Kumar, G.S., Eqbal, S. & Sobhia, M.E. (2018) Screening and identification of potential PTP1B allosteric inhibitors using in silico and in vitro approaches. PLoS One. 18, 13(6), e0199020. DOI
- Reddy, M.V., Ghadiyaram, C., Panigrahi, S.K., Krishnamurthy, N.R., Hosahalli, S., Chandrasekharappa, A.P., Manna, D., Badiger, S.E., Dubey, P.K. & Mangamoori, L.N. (2014) X-ray structure of PTP1B in complex with a new PTP1B inhibitor. Protein Pept Lett. 21(1), 90-3. DOI
- Iversen, L.F., Andersen, H.S., Branner, S., Mortensen, S.B., Peters, G.H., Norris, K., Olsen, O.H., Jeppesen, C.B., Lundt, B.F., Ripka, W., Møller, K.B. & Møller, N.P. (2000) Structure-based design of a low molecular weight, nonphosphorus, nonpeptide, and highly selective inhibitor of protein-tyrosine phosphatase 1B. J Biol Chem. 275(14), 10300-7. DOI
- Wiesmann, C., Barr, K.J., Kung, J., Zhu, J., Erlanson, D.A., Shen, W., Fahr, B.J., Zhong, M., Taylor, L., Randal, M., McDowell, R.S. & Hansen, S.K. (2004) Allosteric inhibition of protein tyrosine phosphatase 1B. Nat Struct Mol Biol. 11(8):730-7. DOI
- Cai, X., Han, X., Luo, Y. & Ji, L. (2013) Comparisons of the efficacy of alpha glucosidase inhibitors on type 2 diabetes patients between Asian and Caucasian. PLoS One. 8(11):e79421. DOI
- Goodman, B.E. (2010) Insights into digestion and absorption of major nutrients in humans. Adv. Physiol. Educ. 34, 44–53, 2010; DOI:10.1152/advan.00094.2009 DOI
- Kumar, S., Narwal, S., Kumar, V. & Prakash, O. (2011) α-glucosidase inhibitors from plants: A natural approach to treat diabetes. Pharmacogn. Rev. 5(9), 19-29. DOI
- Yin, Z., Zhang, W., Feng, F., Zhang, Y. & Kang, W. (2014) α-Glucosidase inhibitors isolated from medicinal plants. Food Sci. Hum. Wellness. 3(3-4), 136-174. DOI
- Chapman, V.J. & Champman, D.J. (1980) ‘‘Seaweeds and Their Uses,’’ Champman and Hall, New York, pp. 62–97. DOI
- Hoppe, H.A. & Lerving, T. (1982) ‘‘Marine Algae in Pharmaceutical Science’’. Vol 2 Walter de Gruyter, Berlin, pp. 3–48. DOI
- Majee, S.B., Avlani, D. & Biswas, G.R. (2017). Pharmacological, pharmaceutical, cosmetic and diagnostic applications of sulfated polysaccharides from marine algae and bacteria. Afr. J. Pharm. Pharmacol. 11(5), 68-77. DOI
- Cardoso, S.M., Pereira, O.R., Seca, A.M., Pinto, D.C. & Silva, A. (2015) Seaweeds as preventive agents for cardiovascular diseases: From nutrients to functional foods. Mar Drugs, 13, 6838-6865. DOI
- Albertus, J.S. (2004) Medicinal and pharmaceutical uses of seaweed natural products: A review. J. Applied Phycol. 16, 245-262. DOI
- Hwang, E.K., Amano, H. & Park, C.S. (2008) Assessment of the nutritional value of Capsosiphon fulvescens (Chlorophyta): developing a new species of marine macroalgae for cultivation in Korea. J. Appl. Phycol., 20(2), 147-151. DOI
- Brown, E.S., Allsopp, P.J., Magee, P.J., Gill, C.I., Nitecki, S., Strain, C.R. & McSorley, E.M. (2014) Seaweed and human health. Nutr Rev. 72(3), 205-16. DOI
- Sharifuddin, Y., Chin, Y., Lim P., Phang, S. (2015) Potential bioactive compounds from seaweed for diabetes management. Mar. Drugs. 13, 5447-5491. DOI
- Kwon, M.J. & Nam, T.J. (2006) Effects of mesangi (Capsosiphon fulvescens) powder on lipid metabolism in high cholesterol fed rats. J. Korean Soc. Food Sci. Nutr. 35(5), 530-535. DOI
- Cho, M., Kang, I.J., Won, M.H., Lee, H.S. & You, S. (2010) The antioxidant properties of ethanol extracts and their solvent-partitioned fractions from various green seaweeds. J Med Food. 13(5), 1232-9. DOI
- Kim, Y.M., Kim, I.H. & Nam, T.J. (2012) Induction of apoptosis signaling by glycoprotein of Capsosiphon fulvescens in human gastric cancer (AGS) cells. Nutr. Cancer. 64, 761-769. DOI
- Moon, H.E., Islam, N., Ahn, B.R., Chowdhury, S.S., Sohn, H.S., Jung, H.A. & Choi, J.S. (2011) Protein tyrosine phosphatase 1B and α-glucosidase inhibitory phlorotannins from edible brown algae, Ecklonia stolonifera and Eisenia bicyclis. Biosci Biotechnol Biochem. 75(8), 1472-80. DOI
- Unnikrishnan, P.S., Suthindhiran, K. & Jayasri, M.A. (2015) Antidiabetic potential of marine algae by inhibiting key metabolic enzymes. Frontiers in Life Science, 8(2), 148-159, DOI
- Lee, S.H., Li, Y., Karadeniz, F., Kim, M.M. & Kim, S.K. (2008). α-glucosidase and α-amylase inhibitory activities of phloroglucinol derivatives from edible marine brown alga, Ecklonia cava. J. Sci. Food Agric. 89:1552–1558. DOI
- Chin, Y.X., Lim, P.E., Maggs, C.A., Phang, S.M., Sharifuddin, Y. & Green, B.D. (2014) Anti-diabetic potential of selected Malaysian seaweeds. J. Appl. Phycol. DOI
- Noda, H., Amano, H., Arashima, K., Hashimoto, S. & Nisizawa, K. (1989) Studies on the antitumour activity of marine algae. Nippon Suisan Gakkaishi. 55, 1259-1264. DOI
- Okada, Y., Ishimaru, A., Suzuki, R. & Okuyama, T. (2004) A new phloroglucinol derivative from the brown alga Eisenia bicyclis: potential for the effective treatment of diabetic complications. J Nat Prod., 67, 103-105. DOI
- Shibata, T., Fujimoto, K., Nagayama, K., Yamaguchi, K. & Nakamura, T. (2002) Inhibitory activity of brown algal phlorotannins against hyaluronidase. Int J Food Sci Technol. 37, 703-709. DOI
- Shibata, T., Nagayama, K., Tanaka, R., Yamaguchi, K. & Nakamura, T. (2003) Inhibitory effects of brown algal phlorotannins on secretory phospholipase A2s, lipoxygenases and cyclooxygenases. J Appl Phycol. 15, 61-66. DOI
- Wijesekara, I., Yoon, N.Y. & Kim, S. (2010) Phlorotannins from Ecklonia cava (Phaeophyceae): Biological activities and potential health benefits. BioFactors. 36(6):408-414. doi: 10.1002/biof.114. DOI
- Li, Y., Qian, Z.J., Ryu, B.M., Lee, S.H., Kim, M.M. & Kim, S.K. (2009) Chemical components and its antioxidant properties in vitro: An edible marine brown alga, Ecklonia cava. Bioorg. Med. Chem. 17, 1963-1973. DOI
- Kong, C.S., Kim, J.A., Yoon, N.Y., Kim, S.K. (2009) Induction of apoptosis by phloroglucinol derivative from Ecklonia cava in MCF-7 human breast cancer cells. Food Chem. Toxicol. 47, 1653-1658. DOI
- Athukorala, Y. & Jeon, Y.J. (2005) Screening for Angiotensin 1-converting enzyme inhibitory activity of Ecklonia cava. J. Food Sci. Nutr. 10, 134-139. DOI
- Lee, S.H., Li, Y., Karadeniz, F., Kim, M.M., Kim, S.K. (2009) α–Glycosidase and α–amylase inhibitory activities of phloroglucinal derivatives from edible marine brown alga, Ecklonia cava. J. Sci. Food Agric. 89, 1552-1558. DOI
- Ogunwa, T.H. (2018) Binding model of antidiabetic constituents from capsosiphon fulvescens with human aldose reductase. Op Acc J Bio Eng & Bio Sci 1(2), 1-7. OAJBEB.MS.ID.000110 DOI
- Ogunwa, T.H. & Ayenitaju, F.C. (2017) An insight into the precise molecular interaction and inhibitory potential of amentoflavone and its substituted derivatives on human α-amylase. Arch. Curr. Res. Int. 10(1), 1-14. DOI
- Trott, O. & Olson, A.J. (2010) AutoDock Vina: Improving the speed and accuracy of docking with a new scoring function, efficient optimization and multithreading. J. Comput. Chem. 31, 455-461. DOI
- Seelinger, D. & de Groot, B.L. Ligand docking and binding site analysis with PYMOL and Autodock/Vina. J. Comput. Aided Mol. Des. 24, 417-422. DOI
- Laskowski, R.A. & Swindells, M.B. (2011) LigPlot+: multiple ligand-protein interaction diagrams for drug discovery. J. Chem. Inf. Model. 51(10), 2778-86. DOI
- Fricker, P., Gastreich, M. & Rarey, M. (2004) Automated generation of structural molecular formulas under constraints. J. Chem. Info. Comput. Sci. 44(3), 1065-1078. DOI
- Hevener, K.E., Zhao, W., Ball, D.M., Babaoglu, K., Qi, J., White, S.W. & Lee, R.E. (2009) Validation of molecular docking programs for virtual screening against dihydropteroate synthase. J. Chem. Inf. Model. 49(2), 444-60. DOI
- Nisha, C.M., Kumar, A., Vimal, A., Bai, B.M., Pal, D. & Kumar, A. (2016) Docking and ADMET prediction of few GSK-3 inhibitors divulges 6-bromoindirubin-3-oxime as a potential inhibitor. J. Mol. Graph. Model. 65, 100-107. DOI
- Kang, S.M., Heo, S.J., Kim, K.N., Lee, S.H., Yang, H.M., Kim, A.D., Jeon, Y.J. (2012) Molecular docking studies of a phlorotannin, dieckol isolated from Ecklonia cava with tyrosinase inhibitory activity. Bioorg Med Chem. 20(1), 311-6. DOI
- Lopes, G., Andrade, P.B. & Valentão, P. (2016) Phlorotannins: Towards New Pharmacological Interventions for Diabetes Mellitus Type 2. Molecules. 22(1). pii: E56. DOI
- Bischoff, H. (1995) The mechanism of α--glucosidase inhibition in the management of diabetes. Clin. Invest. Med. 18(4), 303-311. DOI
- Luthra, T., Agarwal, R., Estari, M., Adepally, U. & Sen, S. (2017) A novel library of α-arylketones as potential inhibitors of α-glucosidase: their design, synthesis, in vitro and in vivo studies. Sci. Rep. 7, 13246−13426. DOI
- Yashihito, O., Akiko, I., Ryuichiro, S., & Toru, O, (2004) A new phloroglucinol derivative from the brown alga Eisenia bicyclis: Potential for the effective treatment of diabetic complications. J. Nat. Prod., 67, 103-105. DOI
- Lee, S.H., Park, M.H., Heo, S.J., Kang, S.M., Ko, S.C., Han, J.S. & Jeon, Y.J. (2010) Dieckol isolated from Ecklonia cava inhibits α-glucosidase and α-amylase in vitro and alleviates postprandial hyperglycemia in streptozotocin-induced diabetic mice. Food Chem. Toxicol. 48, 2633-2637. DOI
- Lee, S.H., Park, M.H., Kang, S.M., Ko, S.C., Kang, M.C., Cho, S., Park, P.J., Jeon, B.T., Kim, S.K., Han, J.S. & Jeon, Y.J. (2012) Dieckol isolated from Ecklonia cava protects against high-glucose induced damage to rat insulinoma cells by reducing oxidative stress and apoptosis. Biosci Biotechnol Biochem. 76(8), 1445-51. DOI
- Eom, S.H., Lee, S.H., Yoon, N.Y., Jung, W.K., Jeon, Y.J., Kim, S.K., Lee, M.S. & Kim, Y.M. (2012) α-Glucosidase- and α-amylase-inhibitory activities of phlorotannins from Eisenia bicyclis. J Sci Food Agric. 92(10), 2084-90. DOI
- Barde, S.R., Sakhare, R.S., Kanthale, S.B., Chandak, P.G. & Jamkhande, P.G. (2015) Marine bioactive agents: A short review on new marine antidiabetic compounds. Asian Pac. J. Trop. Dis. 5, 209-213. DOI