Протеомный анализ ворсин хориона человека при анэмбрионии
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121, Москва, Погодинская ул. 10; *e-mail: cyp450@mail.ru
2East China University of Technology, Nanchang, 330013, China
3Российский национальный исследовательский медицинский университет
имени Н.И. Пирогова, 117997, Москва, ул. Островитянова 1
Центр планирования семьи и репродукции, 117209, Москва, Севастопольский проспект 24а
Ключевые слова: ворсины хориона; анэмбриония; тандемная масс-спектрометрия; биоинформатический анализ; хромосома 18 человека
DOI:10.18097/BMCRM00076
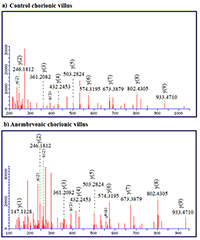
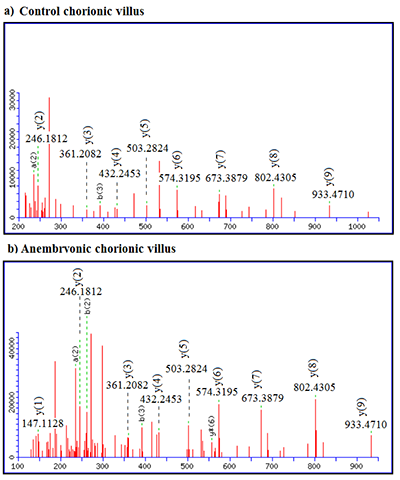
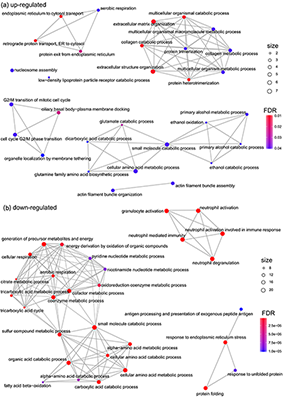
В данной работе протеомный подход, основанный на жидкостной хроматографии, совмещенной с тандемной масс-спектрометрией (LC-MS/MS), и биоинформатический анализ были применены для выявления различий между белковым профилем ворсин хориона человека при анэмбриональной беременности по сравнению с нормальной. Всего в солюбилизированной фракции хориона было идентифицировано около 600 белков. Сравнительный протеомный анализ с использованием программного обеспечения Progenesis LS-MS показал изменение содержания 187 белков при анэмбрионии, из них 134 белка продемонстрировали снижение и 53 белка – повышение концентрации (average normalized abundances). Биоинформатический анализ свидетельствует, что эти белки принимают участие в различных метаболических процессах, включая метаболизм алкоголя и трикарбоновых кислот, в реакциях, ассоциируемых со стрессом эндоплазматического ретикулума, процессах катаболизма, клеточном дыхании и других. Кроме того, зарегистрировано изменение содержания белков, кодируемых хромосомой 18 человека, принимающих участие в апоптозе и реакциях метаболизма лекарственных средств, а также процессах, играющих важную роль при потерях в ранние сроки беременности. Наши предварительные результаты демонстрируют эффективность LC-MS/MS для выявления качественных и полуколичественных различий белкового профиля ворсин хориона при анэмбриональной беременности по сравнению с нормальной. Сделан вывод о том, что широкомасштабное профилирование дифференциально регулируемых белков ворсин хориона может быть полезно для понимания биологических процессов, протекающих при патологии беременности.
|
ЗАКРЫТЬ

|
Таблица 1.
Список 20 белков, идентифицированных методом LC-MS/MS, с наиболее выраженным повышением или снижением содержания в ворсинах хориона при анэмбрионии.
|
|
ЗАКРЫТЬ

|
Таблица 2.
Список Nt-ацетилированных пептидов, идентифицированных в ворсинах хориона при нормальной беременности (контроль) и анэмбрионии, выявленных при поиске в программе Mascot, используя в качестве дополнительной вариабельной модификации N-концевое ацетилирование белка (Nt-ацетилирование).
|
БЛАГОДАРНОСТИ
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий наук на 2013–2020 годы.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00076) на сайте журнала.
ЛИТЕРАТУРА
- Carlson, L.M., & Vora, N.L. (2017). Prenatal Diagnosis: Screening and Diagnostic Tools. Obstet Gynecol Clin North Am., 44(2), 245-256. DOI
- Badeau, M., Lindsay, C., Blais, J., Nshimyumukiza, L., Takwoingi, Y., Langlois, S., Légaré, F., Giguère, Y., Turgeon, A.F., Witteman, W., & Rousseau, F. (2017). Genomics-based non-invasive prenatal testing for detection of fetal chromosomal aneuploidy in pregnant women. Cochrane Database Syst Rev., 11, CD011767. DOI
- Petushkova, N.A. (1991). First-trimester diagnosis of an unusual case of alpha-mannosidosis. Prenat Diagn., 11(5) 279-283. DOI
- Verma, J., Bijarnia-Mahay, S., & Verma, I.C. (2017). Prenatal Diagnosis of Lysosomal Storage Disorders Using Chorionic Villi. Methods Mol Biol., 159(4), 265-291. DOI
- Sun, Y.V., & Hu, Y.J. (2016). Integrative Analysis of Multi-omics Data for Discovery and Functional Studies of Complex Human Diseases. Adv Genet., 93, 147-190. DOI
- Liu, A.X., Jin, F., Zhang, W.W., Zhou, T.H., Zhou, C.Y., Yao, W.M., Qian. Y.L. , & Huang, H.F. (2006). Proteomic analysis on the alteration of protein expression in the placental villous tissue of early pregnancy loss. Biol Reprod., 75(3), 414-420. DOI
- Ni, X., Li, X., Guo, Y., Zhou. T., Guo, X., Zhao, C., Lin, M., Zhou, Z., Shen, R., Guo, X., Ling, X., & Huo, R. (2014). Quantitative proteomics analysis of altered protein expression in the placental villous tissue of early pregnancy loss using isobaric tandem mass tags. Biomed Res Int., 647143. DOI
- Kedia, K., Nichols, C.A., Thulin, C.D., & Graves, S.W. (2015). Novel "omics" approach for study of low-abundance, low-molecular-weight components of a complex biological tissue: regional differences between chorionic and basal plates of the human placenta. Anal Bioanal Chem., 407(28), 8543-8556. DOI
- Xanthopoulou, A.G., Anagnostopoulos, A.K., Thanasopoulou, A., Anastasiadou, E., Sifakis, S., Siafaka-Kapadai, A., & Tsangaris, G.T. (2011). The proteome of normal human chorionic villus sampling cells. In Vivo, 25(6), 945-961. DOI
- Luo, Q., Jiang, Y., Jin, M., Xu, J., & Huang, H.F. (2013). Proteomic analysis on the alteration of protein expression in the early-stage placental villous tissue of electromagnetic fields associated with cell phone exposure. Reprod Sci., 20(9), 1055-1061. DOI
- Xin, L., Xu, B., Ma, L., Hou, Q., Ye, M., Meng, S., Ding, X., & Ge, W. (2016). Proteomics study reveals that the dysregulation of focal adhesion and ribosome contribute to early pregnancy loss. Proteomics Clin Appl., 10(5), 554-563. DOI
- Fujikura, T., Froehlich, L.A., & Driscoll, S.G. (1966). A simplified anatomic classification of abortions. Am J Obstet Gynecol., 95(7), 902-905. DOI
- Chen, H.F., Chao, K.H., Shew, J.Y., Yang, Y.S., & Ho, H.N. (2004). Expression of leukemia inhibitory factor and its receptor is not altered in the decidua and chorionic villi of human anembryonic pregnancy. Hum Reprod., 19(7), 1647-1654. DOI
- Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 72, 248–254. DOI
- Rodchenkova, M., & Novikova, S. (2013). Optimization of liquid chromatography with mass spectrometric detection method for the qualitative and semi-quantitative proteomic analysis. Analitika, 3(10), 40-47.
- Petushkova, N.A., Zgoda, V.G., Pyatnitskiy, M.A., Larina, O.V., Teryaeva, N.B., Potapov, A.A., & Lisitsa, A.V. (2017). Post-translational modifications of FDA-approved plasma biomarkers in glioblastoma samples. PLoS One, 12(5), e0177427. DOI
- Elias, J. E., & Gygi, S.P. (2007). Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nat. Methods, 4, 207–214. DOI
- Yu, G., Wang, L.G., Han, Y., & He, Q.Y. (2012). ClusterProfiler: an R package for comparing biological themes among gene clusters. OMICS, 16(5), 284-287. DOI
- Demko, Z.P., Simon, A.L., McCoy, R.C., Petrov, D.A., & Rabinowitz, M. (2016). Effects of maternal age on euploidy rates in a large cohort of embryos analyzed with 24-chromosome single-nucleotide polymorphism-based preimplantation genetic screening. Fertil Steril, 105(5), 1307 – 1313. DOI
- Blaschitz, A., Weiss, U., Dohr, G., & Desoye, G. (2000). Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta, 21, 733–741. DOI
- Heng, S., Cervero, A., Simon, C., Stephens, A.N., Li, Y., Zhang, J. Paule, S., Rainczuk, A., Singh, H., Quinonero, A., Tapia, A., Velasquez, L., Salamonsen, L., Rombauts, L.J. , & Nie, G. (2011). Proprotein convertase 5/6 is critical for embryo implantation in women: regulating receptivity by cleaving EBP50, modulating ezrin binding, and membrane-cytoskeletal interactions. Endocrinology, 152, 5041–5052. DOI
- Yamada, K.D., Omori, S., Nishi, H., & Miyagi, M. (2017). Identification of the sequence determinants of protein N-terminal acetylation through a decision tree approach. BMC Bioinformatics, 18(1), 289. DOI
- Cao, W., Liu, N., Tang, S., Bao, L., Shen, L., Yuan, H., Zhao, X., & Lu, H. (2008). Acetyl-Coenzyme A acyltransferase 2 attenuates the apoptotic effects of BNIP3 in two human cell lines. Biochim Biophys Acta, 1780(6), 873-880. DOI
- Ryu, S.J., & Park, S.C. (2009). Targeting major vault protein in senescence-associated apoptosis resistance. Expert Opin Ther Targets, 13(4), 479-484. DOI
- Hargreaves, G.A., Quinn, H., Kashem, M.A., Matsumoto, I., & McGregor, I.S. (2009). Proteomic analysis demonstrates adolescent vulnerability to lasting hippocampal changes following chronic alcohol consumption. Alcohol Clin Exp Res., 33(1), 86-94. DOI
- Zou, Y., Yu, X., Lu, J., Jiang, Z., Zuo, Q., Fan, M., Huang, S., & Sun, L. (2015). Decorin-Mediated Inhibition of Human Trophoblast Cells Proliferation, Migration, and Invasion and Promotion of Apoptosis In Vitro. Biomed Res Int., 2015, 201629. DOI
- Kokkinos, M.I. (2009). A novel role for ac-FOX-O1 in fetal membrane rupture. Reprod Sci., 16(7), 625 - 626. DOI
- Jadhav, A.A., & Jain, A. (2013). Adenosine deaminase activity in normal pregnancy and pregnancy associated disorders. Arch Physiol Biochem., 119(2), 88 – 91. DOI
- Varland, S., Osberg, C., & Arnesen, T. (2015). N-terminal modifications of cellular proteins: The enzymes involved, their substrate specificities and biological effects. Proteomics, 15(14), 2385 - 2401. DOI