|
Использование метода количественной ПЦР для диагностики
1ООО НПФ «Литех», 107023 г.Москва, ул. Малая Семеновская, 3А, стр. 2;
Ключевые слова: ПЦР в реальном времени; Eggerthella; Bacterial Vaginosis–Associated Bacteria 2; Megasphaera DOI: 10.18097/BMCRM00084 ВВЕДЕНИЕ Микроэкосистема влагалища обладает высокой восприимчивостью к местным воздействиям и подвержена влиянию половых гормонов. Её состав зависит от фазы менструального цикла, беременности, менопаузы, сексуальной активности, гигиенических привычек, приёма антибиотиков и других факторов. При использовании противозачаточных средств, смене половых партнёров, применении антибиотиков широкого спектра действия, количество лактобацилл в микрофлоре влагалища может уменьшаться, а доля таких микроорганизмов, как Gardnerella vaginalis, Mycoplasma hominis и анаэробов – возрастать, что приводит к формированию дисбактериоза влагалища – бактериального вагиноза (БВ). Получение корректного представления о составе влагалищной микрофлоры важно в плане предотвращения возникновения как инфекций мочевыводящей системы у женщин, так и инфекций, передающихся половым путём. Любой дисбаланс облигатной и факультативной микрофлоры влагалища вызывает дисбактериоз, который является фактором риска при возникновении инфекции [1]. БВ - наиболее распространённое вагинальное расстройство у женщин репродуктивного возраста [2], которое чаще всего проявляется нехарактерными выделениями из влагалища и может вызывать негативные для организма женщины последствия, такие как преждевременные роды [3], инфекции околоплодных вод [4], хориоамнионит [5], воспалительные заболевания органов малого таза [6-9], цервицит [10, 11] и повышение восприимчивости организма женщины к различным инфекциям - Neisseria gonorrhoeae, Chlamydia trachomatis, Trichomonas vaginalis, HSV-2 [12-14] и HIV [15]. Предполагается, что причиной БВ является не единичный возбудитель, а скорее нарушение общего баланса влагалищной микрофлоры, проявляющееся как уменьшение доли нормальной микрофлоры (Lactobacillus spp.) и интенсивное увеличение титра условно-патогенных аэробных и анаэробных бактерий [16]. Методами классической микробиологии выявляются следующие бактериальные виды – Gardnerella vaginalis, Prevotella spp., Porphyromonas spp., Bacteroides spp., Peptostreptococcus spp., Mobiluncus spp. и Mycoplasma hominis [17]. С развитием различных молекулярно-генетических подходов стало очевидно, что степень разнообразия микробных биотопов была сильно недооценена. Так, в микрофлоре влагалища были обнаружены неизвестные ранее бактерии - Atopobium vaginae, Eggerthella, Megasphaera spp., Leptotrichia spp., Dialister spp. и три вида - BVAB1, BVAB2, BVAB3, принадлежавшие к порядку Clostridiales [18-22]. С учетом того, что БВ может негативно сказываться на здоровье женщин репродуктивного возраста, существует необходимость использования быстрых и точных методов диагностики. Именно поэтому так активно развиваются молекулярно-биологические методы диагностики для изучения разнообразия бактериальной флоры, основанные на количественной полимеразной цепной реакции (ПЦР) [23-25], пиросеквенировании [17] и др. Мы применили набор «Фемоскрин» (см. описание в разделе «Материалы и методы») производства НПФ «Литех» (Россия), разработанный на основе ПЦР в реальном времени, для комплексной диагностики БВ, и сравнили полученные результаты с данными традиционного цитологического исследования. МАТЕРИАЛЫ И МЕТОДЫ В работе использовали 146 мазков слизистой влагалища, поступивших на комплексное микроскопическое исследование в «Лаборатория Литех». Мазки были собраны от женщин репродуктивного возраста – посетителей «Лаборатория Литех». Средний возраст обследуемых составил 29.8 ± 7.5 лет. Состояние влагалищной микрофлоры оценивали по критериям Ньюджента. Для этого мазок слизистой окрашивали по Граму и подсчитывали количество выявленных морфотипов бактерий под иммерсионным микроскопом (Табл. 1)
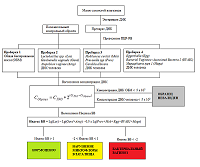
Экстракцию ДНК для ПЦР-анализа проводили с помощью реагента "ДНК-ЭКСПРЕСС" (НПФ «Литех») в соответствии с инструкцией производителя. Выделенные образцы ДНК анализировали с использованием набора реагентов «Фемоскрин» в соответствии с инструкцией производителя. Набор реагентов «Фемоскрин» предназначен для выявления и количественного определения бактерий, ассоциированных с БВ, методом ПЦР с детекцией результатов в режиме реального времени. В результате анализа для каждого образца дается три типа заключения: «нормоценоз», «нарушение микрофлоры влагалища», «бактериальный вагиноз». Общая схема работы с набором представлена на рисунке 1.
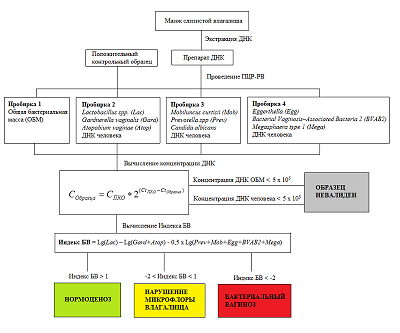
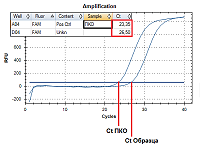
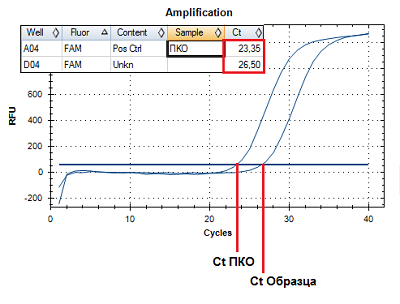
При анализе с помощью набора реагентов «Фемоскрин» один образец ДНК вносят в четыре пробирки, в которых проходит дифференцированное определение следующих микроорганизмов (показателей): Пробирка 1 – Общая бактериальная масса; Пробирка 2 – Lactobacillus spp. + Gardnerella vaginalis + Atopobium vaginae + контроль взятия материала (ДНК человека); Пробирка 3 – Mobiluncus curtisii + Prevotella spp. + Candida albicans + контроль взятия материала (ДНК человека); Пробирка 4 – Eggerthella + Bacterial Vaginosis–Associated Bacteria 2 + Megasphaera type 1 + контроль взятия материала (ДНК человека). При проведении регистрации продуктов амплификации в процессе реакции («в реальном времени») измерения проводятся в каждом цикле амплификации. С использованием специально подобранных настроек анализирующая программа автоматически рассчитывает циклы пересечения кривых накопления флуоресцентного сигнала с пороговой линией (Ct). Значение Ct обратно пропорционально концентрации ДНК в образце. Для количественной оценки значение Ct (цикл пересечения кривой флуоресценции с пороговой линией) исследуемого образца сравнивается со значением Ct ПКО (положительного контрольного образца) с известной концентрацией ДНК (Рис. 2). Концентрация ДНК в исследуемом образце вычисляется по формуле:
Образцы, содержащие недостаточное количество ДНК человека (менее 5 × 103 ГЭ/мл), а также общей бактериальной массы (менее 5 × 105 ГЭ/мл), исключаются из анализа как невалидные. Для остальных образцов производится расчет индекса БВ:
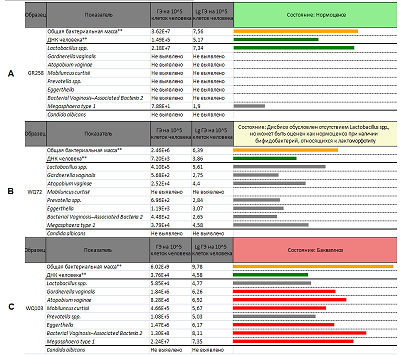
Сокращения обозначают рассчитанную концентрацию ДНК соответствующего микроорганизма в исследуемом образце (в ГЭ/мл): Lac – Lactobacillus spp, Gard - Gardnerella vaginalis, Atop - Atopobium vaginae, Prev - Prevotella spp., Mob - Mobiluncus curtisi; Egg – Eggerthella, BVAB2 - Bacterial Vaginosis–Associated Bacteria 2; Mega - Megasphaera type 1. Если индекс БВ больше 1, то образец относится к группе «Нормоценоз», если меньше 1, но больше -2, то в группу «нарушения микрофлоры влагалища»; если индекс БВ менее -2, то образец относится к группе «Бактериальный вагиноз». Возможна автоматическая интерпретация результатов анализа с помощью вспомогательной программы. Примеры представлены на рисунке 3.
Цветные столбцы отражают графическое представление десятичного логарифма концентрации ДНК соответствующего микроорганизма на 100000 клеток человека. Желтый цвет столбцов относится к показателю «Общая бактериальная масса», зеленый – к показателям «ДНК человека» и Lactobacillus spp. Красный цвет столбцов для условно патогенных возбудителей означает превышение содержания ДНК возбудителя над установленным производителем набора реагентов пороговым уровнем, серый – содержание ДНК возбудителя не превышает порогового уровня. РЕЗУЛЬТАТЫ На основании данных цитологического исследования была сформирована выборка, содержащая 146 образцов, в которую вошли образцы от пациенток с диагнозом «бактериальный вагиноз» (10/146, 6.8%), с нарушением микрофлоры влагалища (промежуточная микрофлора, 73/146, 50.0%) и с нормоценозом (63/146, 43.2%). По результатам тестирования образцов с использованием набора реагентов «Фемоскрин» 81 образец был отнесен к категории «нормоценоз», 53 – к категории «нарушение микрофлоры влагалища» и 12 – к категории «бактериальный вагиноз». В группе пациенток с нормоценозом (n = 63), по результатам тестирования набором «Фемоскрин», к категории «нормоценоз» было отнесено 59 образцов (59/63, 93.7%). В группе пациенток с нарушением микрофлоры влагалища (n = 73), по данным набора «Фемоскрин», к категории «нарушение микрофлоры влагалища» было отнесено 48 образцов (48/73; 65.8 %). В группе пациенток с бактериальным вагинозом (n = 10), установленным по данным цитологического исследования, диагноз был подтвержден для 9 пациенток (9/10, 90.0%) ОБСУЖДЕНИЕ Методы молекулярной диагностики, основанные на ПЦР, становятся все более распространенными благодаря ряду преимуществ, среди которых все большее значение приобретают простота работы, возможность автоматизации и меньший субъективизм при интерпретации результата. Активно разрабатываются наборы реагентов на основе количественной ПЦР в «реальном времени» для изучения разнообразия бактериальной флоры [23-25]. Мы применили набор «Фемоскрин» для комплексной диагностики бактериального вагиноза, и сравнили полученные результаты с данными традиционного цитологического исследования. В группе образцов с установленным диагнозом «бактериальный вагиноз» существенных расхождений между результатами генетического и цитологического исследования обнаружено не было. Наблюдаемые небольшие расхождения в группах «нормоценоз» и «нарушение микрофлоры влагалища», вероятно, связаны с тем, что начальные патологические изменения (пограничные состояния) не всегда могут быть однозначно интерпретированы в сторону одного или другого состояния. Подобные результаты, когда не может быть выявлена чёткая разница между нормоценозом и начинающимся нарушением микрофлоры влагалища – достаточно распространённое явление, которое описано в других подобных исследованиях [26]. Сопоставление данных, полученных с помощью набора «Фемоскрин», с результатами цитологического исследования позволили оценить диагностическую чувствительность и специфичность по отношению к диагнозу «бактериальный вагиноз». Диагностическая чувствительность набора рассчитывалась как отношение числа истинно положительных результатов нового теста к сумме истинно положительных и ложноотрицательных образцов нового теста:
Диагностическая чувствительность набора реагентов «Фемоскрин» составила 90.0% (55.5 – 99.8%) для БВ. Диагностическая специфичность рассчитывалась как отношение истинно отрицательных результатов нового теста к сумме истинно отрицательных и ложноположительных результатов нового теста:
Диагностическая специфичность набора реагентов «Фемоскрин» составила 97.8 % (93.7- 99.5%) для БВ. Доверительные интервалы были посчитаны с помощью онлайн сервиса https://www.medcalc.org/calc/diagnostic_test.php. Данные суммированы в таблице 2.
ЗАКЛЮЧЕНИЕ И ВЫВОДЫ По результатам проведенного анализа можно сделать вывод о том, что набор реагентов «Фемоскрин» может служить дополнительным инструментом тестирования при микроскопическом (цитологическом) исследовании влагалищной микрофлоры, т.к. он показал высокую эффективность и минимальное количество невалидных результатов. Результаты, полученные с помощью набора реагентов «Фемоскрин», хорошо коррелирует с данными цитологии. Набор сочетает в себе функционал близких аналогов - с одной стороны, позволяет проанализировать состав микробиоты урогенитального тракта аналогично серии наборов реагентов «Фемофлор» (НПФ «ДНК-технологии», Россия), с другой стороны, позволяет диагностировать бактериальный вагиноз аналогично набору реагентов «Флороценоз-БВ» ( «Интерлабсервис», Россия). СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ До включения в исследование у всех участников было получено письменное информированное согласие на использование их биоматериала. ЛИТЕРАТУРА
|