|
Применение ИК-Фурье-спектроскопии слюны для экспресс-оценки уровня продуктов липопероксидации
Омский государственный педагогический университет, 644043, Омск, ул. Тухачевского 14; Ключевые слова: слюна; ИК-спектроскопия; перекисное окисление липидов DOI: 10.18097/BMCRM00094 ВВЕДЕНИЕ Известно, что в регуляции интенсивности адаптационных реакций организма, поддержании нормального метаболического фона, а также функциональной активности клеток важную роль играют процессы перекисного окисления липидов (ПОЛ) [1]. Нарушения отдельных звеньев гомеостаза, в том числе баланса между интенсивностью ПОЛ и активностью системы антиоксидантной защиты, могут являться неспецифичными факторами эндогенного риска развития многих хронических неинфекционных заболеваний – атеросклероза, рака, сахарного диабета и т.д. [2]. В целом, усиление ПОЛ является универсальным неспецифическим патогенетическим звеном в развитии заболеваний и патологических процессов [3, 4]. В качестве распространенного метода определения продуктов ПОЛ (диеновых конъюгатов, триеновых конъюгатов и оснований Шиффа) используют спектрофотометрический метод [5]. Содержание конечного продукта ПОЛ – малонового диальдегида (МДА) – определяют по реакции с тиобарбитуровой кислотой [6]. Возможности современных физико-химических методов, в том числе хроматографии и масс-спектроскопии, позволяют определять более широкий спектр продуктов ПОЛ [7]. Однако данные методы являются длительными и дорогостоящими, а также зачастую не предназначены для анализа биологических образцов, содержащих небольшие количества продуктов ПОЛ. Описан метод определения продуктов ПОЛ с применением ИК-спектроскопии, основными достоинствами которого являются экспрессность и высокая чувствительность [8]. В настоящее время внимание большого числа исследователей привлекает слюна в качестве информативного биоматериала, т.к. она позволяет проводить неинвазивную диагностику и мониторинг параметров организма человека [9-11]. ИК-спектроскопия слюны является одновременно экспрессным и неинвазивным методом анализа, что позволяет использовать ее не только для диагностики ряда заболеваний, но и для изучения метаболических процессов, адаптационных изменений, в том числе и для решения задач медицинской экологии [12]. Цель работы – определение возможности анализа продуктов ПОЛ с использованием ИК-спектроскопии слюны. В качестве заболеваний, при которых увеличение уровня продуктов ПОЛ в биологических жидкостях, в том числе и слюне, хорошо изучено, нами выбраны онкологические заболевания: рак легкого и рак молочной железы как наиболее распространенные среди мужского и женского населения [13]. МАТЕРИАЛЫ И МЕТОДЫ В исследовании случай–контроль приняли участие добровольцы, которые были разделены на 2 группы: основную (с диагнозом рак легкого и рак молочной железы) и контрольную (условно здоровые). Основная группа включала 40 больных раком легкого (плоскоклеточный рак – 16, аденокарцинома – 16, нейроэндокринные опухоли – 8 человек) и 50 больных раком молочной железы. Контрольная группа включала 113 условно здоровых пациентов (55 мужчин, 58 женщин), у которых при проведении плановой диспансеризации не было выявлено патологии легких и молочных желез. Включение в группы происходило параллельно. В качестве критериев включения рассматривали: возраст пациентов 30–75 лет; отсутствие какого-либо лечения на момент проведения исследования, в том числе хирургического, химиотерапевтического или лучевого; отсутствие признаков активной инфекции (включая гнойные процессы); проведение санации полости рта. Критерии исключения - отсутствие гистологической верификации диагноза. У всех участников до начала лечения проводили забор слюны в количестве 2 мл. Образцы слюны собирали утром натощак путем сплевывания в стерильные пробирки, центрифугировали при 7000 об/мин (центрифуга ЦЛн-16, ротор 4). Образцы объемом 50 мкл высушивали на подложке из селенида цинка в термостате при 37°С. ИК-спектры поглощения регистрировали на ИК-Фурье-спектрометре «ФТ-801» (СИМЕКС) в диапазоне 500 – 4000 см-1. Во всех образцах определяли содержание продуктов ПОЛ (диеновых и триеновых конъюгатов, оснований Шиффа, МДА) [5, 6]. При определении концентрации ацилгидроперекисей в отдельную пробирку отбирали 200 мкл слюны, добавляли 4 мл смеси гептан - изопропанол (1 : 1) и встряхивали 10 - 15 мин, после чего в нее добавляли 1 мл раствора HСl (рН 2) и 2 мл гептана, интенсивно встряхивали, отстаивали в течение 20 - 25 мин и из полученной в результате расслоенной на фазы смеси отбирали верхний гептановый слой и определяли в нем концентрацию ацилгидроперекисей по степени светопоглощения при длинах волн 220 нм, 232 нм, 278 нм и 400 нм, при этом светопоглощение при длине волны 220 нм (Е220) соответствует поглощению изолированных двойных связей, светопоглощение при длине волны 232 нм (Е232) соответствует поглощению диеновых конъюгатов, светопоглощение при длине волны 278 нм (Е278) соответствует поглощению триеновых конъюгатов, светопоглощение при длине волны 400 нм (Е400) соответствует поглощению оснований Шиффа. Для повышения точности определения и устранения приборных погрешностей рассчитывали соотношения Е232/Е220, Е278/Е220, Е400/Е220 и выражали содержание продуктов ПОЛ в относительных единицах: диеновых конъюгатов как Е232/Е220, триеновых конъюгатов как Е278/Е220 и оснований Шиффа как Е400/Е220. Метод определения малонового диальдегида (МДА) основан на том, что при высокой температуре в кислой среде МДА реагирует с тиобарбитуровой кислотой (ТБК), образуя окрашенный триметиновый комплекс розового цвета с максимумом поглощения при 535 нм. К 200 мкл слюны добавляли 2 мл дистиллированной воды, 1 мл 0.6% ТБК в ледяной уксусной кислоте. Пробы кипятили 30 мин, охлаждали и добавляли 1 мл 5% КОН и 2 мл изопропилового спирта. Центрифугировали при 6000 об/мин 20 минут, затем колориметрировали при 535 нм и 580 нм против контроля, содержащего вместо слюны воду. Статистический анализ полученных данных выполнен при помощи программ Statistica 10.0 (StatSoft) непараметрическим методом с использованием в зависимых группах критерия Вилкоксона, в независимых группах – U-критерия Манна-Уитни. Описание выборки производили с помощью подсчета медианы (Ме) и интерквартильного размаха в виде 25-го и 75-го процентилей [LQ; UQ]. Различия считали статистически значимыми при p ˂ 0.05. Корреляционный анализ проведен с использованием критерия Спирмена. РЕЗУЛЬТАТЫ На первом этапе исследования проведено определение продуктов ПОЛ в слюне здоровых добровольцев, а также больных раком легкого и молочной железы. Поскольку группа больных раком легкого включала пациентов только мужского пола, для корректной оценки полученных результатов контрольная группа также разбита на 2 подгруппы по полу. В исследуемых группах отмечено статистически достоверное увеличение содержания первичных и вторичных продуктов ПОЛ (табл. 1). При этом следует отметить уменьшение содержания МДА на 3.6% на фоне рака легкого, на 15.4% на фоне рака молочной железы.
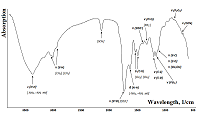
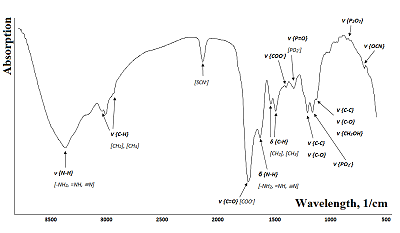
На следующем этапе для всех добровольцев, включенных в исследование, получены ИК-спектры слюны (рис.1).
На ИК-спектре слюны можно выделить три основные группы макромолекул: липиды (3000-2800 см-1), белки (1700-1600 см-1 и 1560 – 1500 см-1) и нуклеиновые кислоты (1250 – 1000 см-1). Широкая полоса поглощения при 3273 см-1 соответствует амиду А. Узкая полоса средней интенсивности при 2057 см-1 относится к тиоцианатным анионам (SCN-). Две узкие полосы, расположенные при 1649 см-1 и 1543 см-1, классифицированы как полосы поглощения амида I и II, соответственно. Полоса, наблюдаемая при 1075 см-1 в спектрах слюны, соответствует фрагментам сахаров. Оставшиеся менее интенсивные полосы поглощения соответствуют метиленовым группам боковых цепей аминокислот в белках и липидах (1452 см-1), боковых цепей аминокислот (1396 см-1), амиду III /фосфолипидам (1286 – 1320 см-1) и фрагментам сахаров, гликозилированных белков и фосфатным группам в нуклеиновых кислотах (1080 – 950 см-1). Более детально полосы поглощения, соответствующие функциональным группам липидов и жирных кислот в составе слюны, описаны в таблице 2.
На ИК спектрах слюны в группах больных раком легкого и раком молочной железы наблюдается общая тенденция изменения интенсивности полос поглощения (табл. 3, 4).
Из литературных данных известно, что дополнительную диагностическую значимость могут иметь не только интенсивности поглощения на определенных длинах волн, но и соотношения интенсивностей отдельных полос поглощения [16]. В связи с этим дополнительно рассчитаны коэффициенты I1400/I1460 – соотношение интенсивностей деформационных колебаний метильной и метиленовой групп жирных кислот, I2850/I1735 – соотношение валентных колебаний неокисленных и окисленных липидов, I2950/I2875 – соотношение, характеризующее длину и степень упорядоченности углерод-углеродных цепей липидов и жирных кислот. Показано, что коэффициент I2950/I2875 при онкологической патологии уменьшается, тогда как коэффициенты I1400/I1460 и I2850/I1735 растут (табл. 3, 4). Можно предположить, что на фоне обеих патологий наблюдается увеличение доли насыщенных связей в структуре липидов (рост коэффициента I1400/I1460) при увеличении общего содержания липидов в слюне. Однако, уровень окисленных продуктов при этом снижается (рост коэффициента I2850/I1735). При расчете коэффициентов корреляции отмечено, что для конечного продукта липопероксидации МДА наблюдаются положительные корреляции с интенсивностью полос поглощения 1400 см-1 (r = 0.4016), 1460 см-1 (r = 0.4247), 2850 см-1 (r = 0.3369), 2875 (r = 0.3487), 2930 см-1 (r = 0.3575) и 2950 см-1 (r = 0.3445). Для вторичных продуктов ПОЛ выявлены отрицательные корреляции с полосами поглощения 970 см-1 (r = -0.1738), 1082 см-1 (r = -0.2310), 1180 см-1 (r = -0.1911) и 1735 см-1 (r = -0.2445). Выявленные корреляционные связи статистически значимы (p < 0.05). Для диеновых конъюгатов статистически значимых коэффициентов корреляции с интенсивностями полос поглощения на ИК спектрах слюны не выявлено. Таким образом, на фоне онкологической патологии наблюдается рост уровня первичных и вторичных продуктов ПОЛ, а также снижение уровня МДА по данным биохимического анализа (табл. см-11). Тогда как на ИК-спектрах наблюдается увеличение интенсивностей полос поглощения липидов, что соответствует росту их общего содержания и коррелирует с содержанием МДА, и уменьшение интенсивностей колебаний кислородсодержащих групп, что соответствует отрицательной корреляции с вторичными продуктами ПОЛ (табл. 3, 4). Для определения содержания продуктов ПОЛ методом ИК-спектроскопии были рассчитаны уравнения множественной регрессии:
Проверка на основе критерия Фишера показала, что уравнения статистически значимы для триеновых конъюгатов и оснований Шиффа (p˂0.05). ОБСУЖДЕНИЕ ИК-спектроскопия позволяет определить совокупный уровень ряда метаболитов, образующихся в процессе патологических изменений, инициированных токсикозом, и, соответственно, оценить степень нарушения метаболических процессов [17]. Максимальные изменения наблюдаются в спектральной области 3000-2850 см-1. Здесь расположены валентные колебания антисимметричных и симметричных метильных и метиленовых групп липидов и фосфолипидов в мембранах. Известно, что интенсивность этих полос увеличивается с увеличением возраста и развития заболевания [18]. Появление олефиновой концевой группы указывает на взаимодействие липидов и фосфолипидов мембран с гидроксильными свободными радикалами, которые образуются при окислительном стрессе. Полоса поглощения 1738 см-1 является важной полосой, связанной с валентными колебаниями карбонильной группы (C=O), она характеризует сложноэфирные связи между жирными кислотами и глицерином в молекулах липидов. Однако этот тип связи может также образовываться при перекисном окислении цепей жирных кислот [19]. Логично предположить, что увеличение интенсивности этой полосы свидетельствует об увеличении окисления липидов в образце, что было подтверждено в литературе [20]. По-видимому, на ИК-спектрах мы регистрируем одновременно как первичные, промежуточные, так и конечные продукты ПОЛ, в связи с чем однозначная интерпретация наблюдаемых изменений затруднена. Дополнительно следует учитывать сложный состав исследуемой биологической жидкости и возможность суммирования сигнала различных молекул в результирующем спектре поглощения. Тем не менее в ходе данной работы получено статистически значимое уравнение регрессии, позволяющее оценивать содержание наиболее токсичного из продуктов ПОЛ – основания Шиффа. Однако учитывая невысокие значения коэффициента детерминации R2, определение продуктов ПОЛ данным методом будет скорее полуколичественным. Тем не менее это может быть использовано для изучения метаболических процессов, адаптационных изменений, в том числе и для решения задач медицинской экологии, особенно в тех случаях, когда важны не абсолютные значения содержания компонентов, а динамика их изменения на фоне тех или иных условий. Следует отметить, что существующие методы определения продуктов ПОЛ достаточно трудоемки и полученные результаты плохо воспроизводимы. В связи с этим, большинство исследований ограничиваются только анализом МДА, что не всегда информативно. Как было отмечено выше, на фоне онкологических заболеваний уровень МДА в целом снижается, что не означает снижение интенсивности процессов липопероксидации, а лишь отражает их смещение в сторону более токсичных промежуточных продуктов [21]. ЗАКЛЮЧЕНИЕ Предложенный в данной работе метод позволяет проводить наблюдение процессов ПОЛ в динамике, а также характеризовать направление смещения равновесия в данных процессах. Выявлены статистически значимые различия в интенсивностях ряда полос поглощения на ИК спектрах между контрольными группами и группами пациентов с онкологическими заболеваниями (рак легкого, рак молочной железы), которые коррелируют с изменением содержания продуктов ПОЛ для данных групп. К ограничениям исследования следует отнести изучение только процессов ПОЛ по ИК спектрам, тогда как следует также учитывать факт присутствия белков, которые также могут подвергаться окислительному воздействию. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Исследования одобрены на заседании комитета по этике БУЗ Омской области «Клинический онкологический диспансер» от 21 июля 2016 г., протокол № 15. ЛИТЕРАТУРА
|