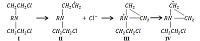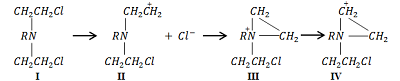|
СОДЕРЖАНИЕ СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Рисунок 1 Механизм повреждающего действия хлорэтиламинов по [4]. Рисунок 2Общая схема реакции синтеза липидного производного сарколизина с деканолом. Рисунок 3Светопропускание при длине волны 660 нм образца лекарственного средства. Рисунок 4. Распределение частиц по размерам в объёме образца лекарственного средства. Таблица 1Характеристика образцов эмульсии, получаемых при различных технологических параметрах. |
Получение и изучение свойств противоопухолевого лекарственного средства на основе липидного производного сарколизина
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, 117198, Москва, ул. Миклухо-Маклая, 16/10, к.7. Ключевые слова: сарколизин; липидное производное; фосфолипидные наночастицы; онкология DOI: 10.18097/BMCRM00098 ВВЕДЕНИЕ Онкологические заболевания во всем мире занимают второе место по смертности после сердечно-сосудистых патологий [1-3]. Повышение эффективности противоопухолевой химиотерапии в настоящее время развивается по разным направлениям. Вместе с поиском и синтезом новых оригинальных препаратов с избирательным действием на опухолевые клетки большое значение имеет и исследования, связанные с оптимизацией методик применения противоопухолевых средств, уже зарекомендовавших себя в медицинской практике, путем совершенствования лекарственных форм, дозирования, схем и режимов введения. Для лечения широкого спектра злокачественных новообразований перспективными и наиболее используемыми являются алкилирующие агенты, в частности, производные бис-(бета-хлорэтил)амина. В настоящее время в медицинской практике применяется наименее токсичное производное - мелфалан, известный под названиями «Сарколизин», «Алкеран». Алкилирующие соединения, легко взаимодействуя с нуклеиновыми кислотами и белками, оказывают общее воздействие на рост опухолевых клеток. Механизм повреждающего воздействия хлорэтиламинов, к числу которых относится сарколизин, заключается в спонтанном (без участия ферментативных систем организма) переносе алкильных групп этих химических соединений на биологические макромолекулы, в том числе и ДНК (рис. 1) . При введении в организм хлорэтиламины (I) отщепляют ионы хлора и образуют электрофильный карбониевый ион (II), который переходит в этиленимоний (III), переходящий в активный карбониевый ион (IV), взаимодействующий с нуклеофильными структурами ДНК. Таким образом происходит алкилирование субстрата [4].
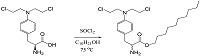
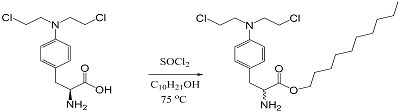
Несмотря на успешное применение в клинике, использование сарколизина ограниченно высокой токсичностью, низкой стабильностью при хранении (чувствительностью к температуре, свету и влаге), низкой растворимостью, а также гидролитической нестабильностью в организме. В водной среде он постепенно гидролизуется, с замещением остатков Cl на гидроксильные группы, что приводит к снижению алкилирующих свойств. К недостаткам сарколизина относят также его быстрый почечный клиренс. Также известно, что фармакокинетика сарколизина сильно зависит от индивидуальных особенностей организма. Cогласно данным литературы, его биодоступность может варьировать от 20% до 80% [5-7]. Несмотря на выраженные недостатки, сарколизин до настоящего времени активно используется в онкологии. В связи с чем проблема поиска новых, эффективных форм сарколизина без снижения его цитостатического действия остается актуальной задачей. Наиболее интересным и быстро развивающимся направлением современных исследований в области медицины и фармации является применение липосом в качестве носителей для доставки лекарственных веществ к патологически измененным клеткам. Применение липосом в качестве систем доставки лекарств сегодня является признанным подходом к повышению эффективности лечения [8-9]. Такой подход способствует повышению переносимости инкапсулированного препарата пациентом, а также позволяет увеличить терапевтический индекс (соотношение терапевтического эффекта и токсичности) лекарства. Однако, несмотря на многообещающие результаты описанные в последние годы в литературе [10-13], существует ряд ограничений, которые препятствуют дальнейшему широкому практическому применению липосом. Среди таких недостатков: (1) "быстрое высвобождение" лекарства, что приводит к низкой активности и проявлению побочных эффектов до наступления терапевтического, или наоборот, замедленное высвобождением лекарственного средства; (2) необходимость использования органических растворителей при инкапсуляции плохо растворимых лекарственных препаратов, которые имеют тенденцию к кристаллизации; (3) доступность для лизиса ретикулоэндотелиальной системой (РЭС); (4) малое количество транспортируемого соединения, ограниченное «внутренним объемом» липосомы [14-15]. Эффективным подходом в преодолении этих недостатков является получение производного лекарственного соединения (пролекарства) с дальнейшим его включением в липосомы. Использование пролекарств для доставки лекарственного средства имеет важные преимущества, такие как: (1) пролонгированное высвобождение лекарства (опосредованное химическим или ферментативным гидролизом пролекарства); (2) увеличение химической стабильности и растворимости лекарства, и (3) уменьшение токсичности [16]. В целом, стратегия пролекарства дает возможность получения готовой формы препарата с заданными физико-химическими, фармакокинетическими и фармакологическими свойствами. В настоящее время для получения пролекарств на основе алкилирующих агентов в качестве липидной составляющей используются следующие вещества - фосфатидилхолин, стеариновая кислота, диолеилглицерин и холестерин. Например, в работе Водовозовой с соавт. сообщается о включении сарколизина и метатрексата в липидный бислой липосом в виде липидных производных – липофильных пролекарств, которые расщепляются внутриклеточными ферментами с высвобождением исходного препарата [17]. В связи с этим целью работы были оптимизация условий получения лекарственного средства на основе липидного производного сарколизина (пролекарства) в форме ультратонкой эмульсии наночастиц (а именно, процесса гомогенизации), изучение физико-химических свойств полученной композиции, а также исследование ее распределения по компонентам плазмы крови и взаимодействие с цельной кровью в экспериментах in vitro. МАТЕРИАЛЫ И МЕТОДЫ В работе использовали следующие материалы и реактивы: сарколизин (2-амино-3-[4-[бис(2-хлороэтил)амино]фенил]пропионовая кислота) 98% («Кемикал Лайн», Россия); деканол (ч.д.а.); метанол HPLC grade («Fisher Scientific UK Ltd», Великобритания), муравьиная кислота 98 - 100% («Merck KGaA», Германия), трифторуксусная кислота (ТФУ) («Fluka Chemie AG», Швейцария), Lipoid S100 («Lipoid», Германия), фосфатносолевой буфер - PBS («Sigma-Aldrich», США), ацетонитрил 99.9% для ВЭЖХ («Sigma-Aldrich»), диметилсульфоксид (ДМСО) (х.ч., Россия), NaOH (х.ч., «Ленреактив», Россия), 0,9% раствор NaCl («Гротекс», Россия). Для приготовления растворов использовали дистиллированную воду. Плазма донорской крови была предоставлена «Московской областной станцией переливания крови». Кровь экспериментальных животных - крыс-самцов линии Wistar - получали в день проведения эксперимента после эвтаназии животных и декапитации, забор крови производили в пробирки с ЭДТА. Синтез и очистка липидного производного сарколизина Для получения липидного производного сарколизина (ЛПС) в двугорлую колбу помещали 4 г (13.1 ммоль) сарколизина и 100 мл безводного деканола (524 ммоль). В полученную смесь в атмосфере аргона при 0°C добавляли 4 мл хлористого тионила SOCl2 (55.1 ммоль) и при интенсивном перемешивании инкубировали 15 мин. Затем температуру водяной бани поднимали до 75°C и при постоянном перемешивании выдерживали до растворения осадка. Реакционную смесь охлаждали, заливали холодным гексаном и выдерживали сутки при −20°С. Осадок промывали холодным гексаном и сушили над P2O5. Остаточное количество деканола в продукте контролировали методом LC-MS согласно [18]. Выход продукта составлял 55%, при этом содержание деканола не превышало 1%. Общая схема реакции синтеза липидного производного сарколизина с деканолом представлена на рисунке 2. Оптимизация условий получения лекарственного средства в форме эмульсии наночастиц и ее характеристика Фармакологическую субстанцию (ФС) ЛПС в составе фосфолипидных наночастиц получали следующим образом: в 80 мл воды диспергировали 3 г фосфолипида Lipoid S100, добавляли 0.3 г конъюгата (липидного производного сарколизина). Доводили водой объём до 120 мл, перемешивали. Полученную грубую эмульсию нагревали на водяной бане до температуры 45°С и подвергали гомогенизации на микрофлюидайзере M110EH30K («Microfluidics», США), варьируя давление (500 атм, 1000 атм или 1500 атм), температуру (35ºС, 45ºС или 55ºС) и количество циклов гомогенизации (3, 5 или 7). Полученные эмульсии фильтровали на установке «Millipore Corporation» (США) и определяли их параметры (указаны ниже) с целью выбора оптимальных условий процесса гомогенизации. Светопропускание и индекс полидисперсности определяли на спектрофотометре Agilent 8453 UV-visible Spectroscopy System («Agilent Technologies», Германия) с помощью программы ChemStation при длине волны 660 нм, в качестве раствора сравнения (бланк) - дистиллированная вода. Размер частиц определяли методом динамического светорассеяния на анализаторе Zetasizer Nano ZS («Malvern», Великобритания). Температуру образца поддерживали на уровне 25°С, время уравновешивания - 3 мин. Стабильность при хранении в растворе оценивали при хранении эмульсии ФС в условиях комнатной температуры в течение 2-х суток, светопропускание, индекс полидисперсности и распределение частиц по размерам определяли каждые 12 ч. Количественное содержание фосфатидилхолина определяли ферментно-колориметрическим методом с помощью тест-набора фирмы «Sentinel Diagnostics» (Италия) на автоматическом анализаторе Global 240. Образец ФС разводили водой в 10 раз (ориентировочно до концентрации фосфолипида 2.5 мг/мл). Для определения фосфатидилхолина 10 мкл образца вносили в 1 мл раствора реагента. Смесь тщательно перемешивали и через 10 мин инкубации при 37°С регистрировали оптическое поглощение при длине волны 520 нм. В качестве стандарта использовали лиофилизированную человеческую сыворотку Clin Chem Control 1 из набора Sentinel Diagnostics с содержанием фосфатидилхолина ССт = 3 мг/мл. Содержание фосфатидилхолина в образце Соб. определяли по формуле (1).
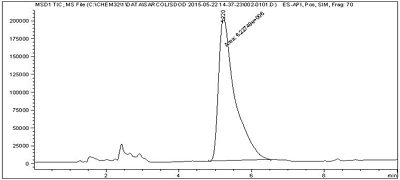
LC/MS-анализ липидного производного сарколизина Содержание ЛПС в ФС определяли методом хромато-масс-спектрометрии (LC/MS) на хроматографе Agilent 1200 Series с масс-спектрометрическим детектором 6130 Quadrupole LC/MS («Agilent Technologies»). Аликвоту эмульсии ФС в 100 раз разбавляли метанолом с 0.1% муравьиной кислотой. С помощью автосамплера 10 мкл пробы вносили на колонку Zorbax SB-C8 размером 3.0 × 150 мм c дисперсностью сорбента 3.5 мкм («Agilent Technologies»). Пробу элюировали смесью 0.1% водного раствора муравьиной кислоты и ацетонитрила с добавлением 0.1% муравьиной кислоты. Использовали градиентный режим элюирования от 70% до 95% ацетонитрила с 0.1% муравьиной кислоты за 10 мин. ЛПС детектировали в образце в виде его положительно заряженного молекулярного иона с соотношением массы к заряду (m/z) 472.2. Время удерживания ЛПС составляло 5.2 мин. Процент включения липидного производного сарколизина в фосфолипидные наночастицы Исследование процента включения ЛПС в фосфолипидные наночастицы проводили методом ультрафильтрации с использованием специальных пробирок Amicon Ultra-0.5 («Millipore Corporation»). Образец (300 мкл) помещали в фильтрующий элемент и центрифугировали на центрифуге Eppendorf mini Spin plus с ротором F-45-12-11 («Eppendorf», Германия) при 7500 об/мин в течение 20мин. Наночастицы, образованные фосфатидилхолином и конъюгатом, не проходили через мембрану, дециловый конъюгат сарколизина, проходя через мембрану, оказывался в фильтрате. Содержание ЛПС в фильтрате оценивали методом LC/MS, описанным выше. Пробу для анализа готовили, добавляя к аликвоте фильтрата 99-кратный избыток метанола с 0.1% муравьиной кислотой. Процент включения ЛПС вычисляли по формуле (2).
Исследования с плазмой и цельной кровью в экспериментах in vitro Для эксперимента раствор ФС с ЛПС (условно названный Сарколизин-НФ) в дистиллированной воде имел концентрацию по ЛПС 7.34 мг/мл (концентрация по сарколизину 5 мг/мл). Раствор свободной субстанции сарколизина с концентрацией 5 мг/мл готовили растворением навески субстанции сарколизина в этаноле, содержащим 5% концентрированной соляной кислоты. После растворения сарколизина к аликвоте 100 мкл добавляли 850 мкл 0.01 М PBS. рН полученной смеси доводили до 5.0 - 5.5 добавлением 50 мкл 1 М раствора NaOH. Для исследования распределения сарколизина по компонентам плазмы крови готовили следующие образцы: 1) 3.8 мл плазмы крови, 0.1 мл метанола и 0.1 мл раствора Сарколизин-НФ; 2) 0.1 мл раствора сарколизина в метаноле и 0.1 мл воды; 3) 3.8 мл плазмы крови, 0.1 мл метанола и 0.1 мл воды (контрольный образец/бланк). Образцы инкубировали при 37°С 30 мин. Для получения фракций, содержащих липопротеины, использовали метод ультрацентрифугирования в градиенте плотности соли NaBr. Смесь центрифугировали на ультрацентрифуге Optima L-90 («Beckman», США) в течение 2 ч (при 20 °С, ротор Ty 65 (Beckman”), скорость вращения ротора 41000 об/мин). Для LC-MS анализа к полученным фракциям после инкубации добавляли 9-кратный избыток метанола, после интенсивного перемешивания в течение 2 - 3 мин, центрифугировали на центрифуге Eppendorf 5810 R (ротор FA-45-30-11) в течение 10 мин (10000 об/мин). Супернатант анализировали на содержание ЛПС и сарколизина методом ВЭЖХ с масс-спектрометрическим детектированием. Расчет количественного содержания ЛПС (с сарколизином в его составе) или сарколизина в свободном виде осуществляли по формуле (3).
Процентное содержание в каждой фракции ЛПС и сарколизина выражали в процентах по отношению к концентрации в исходной инкубационной смеси. Взаимодействие с цельной кровью. Кровь экспериментальных животных в объеме 7-10 мл делили на две аликвоты по 3.8 мл. В кровь добавляли по 200 мкл приготовленных растворов (препаратов Сарколизина-НФ или субстанции сарколизина). Начальная концентрация по сарколизину в обоих образцах составляла 68.5 мкг/мл, по ЛПС – (100±5) мг/мл. После перемешивания через 20 мин, 40 мин, 60 мин, 90 мин, 120 мин и 240 мин из каждой серии отбирали аликвоту крови для экстрагирования 9-кратным объемом метанола с 0.1% муравьиной кислотой и центрифугировали для разделения на плазму и форменные элементы в течение 20 мин при 5000 об/мин и температуре 4ºС на центрифуге Eppendorf 5810 R («Eppendorf», ротор FA-45-30-11). ФЭ трижды промывали 0.9% раствором NaCl. Плазму и ФЭ обрабатывали 9-кратным избытком метанола с 0.1% муравьиной кислоты. Экстракты центрифугировали для осаждения белков при 10000 об./мин в течение 10 мин на центрифуге Eppendorf 5810 R («Eppendorf», ротор FA-45-30-11), супернатант исследовали на содержание ЛПС и сарколизина с помощью LC-MS анализа, концентрацию рассчитывали с учетом разбавления образца крови. РЕЗУЛЬТАТЫ Получение лекарственного средства на основе липидного производного сарколизина в виде эмульсии наночастиц Снижение токсического действия сарколизина на здоровые ткани и повышение его способности транспортироваться в клетки-мишени возможно за счет получения химической модификации сарколизина, способной встраиваться в фосфолипидные наночастицы как систему транспорта. Для лучшего прохождения в липидный бислой мембраны получаемый конъюгат сарколизина (т.е. его химически-модифицированная форма) должен иметь липофильный якорь достаточной длины. Также необходимо, чтобы связь между лекарством и остальной частью молекулы производного могла легко гидролизоваться внутриклеточными ферментами [17]. Поэтому в работе использовали липидное производное сарколизина с деканолом, полученное химическим синтезом с образованием сложноэфирной связи (согласно методике, рис. 2). На примере ряда лекарств (индометацин, арбидол, рифампицин, преднизолон, доксорубицин и др.) было показано увеличение биодоступности, а в ряде случаев повышение специфической активности и снижение нежелательных побочных проявлений при их включении в наночастицы на основе растительных фосфолипидов размером до 50 нм [19-23]. Наиболее технологичным методом получения коллоидных наночастиц на основе фосфолипидов для дальнейшего использования их как транспортной системы, является способ гомогенизации под высоким давлением (500 – 1500 атм) [24]. Преимуществами данного метода являются высокая производительность и минимальное окисление фосфолипидов в процессе обработки.
Технологический процесс получения разрабатываемого лекарственного средства включал следующие стадии: химический синтез липидного производного сарколизина, получение первичной и вторичной эмульсии (наноэмульсии) методом гомогенизации под высоким давлением с помощью микрофлюидайзера M110EH30K («Microfluidics»). С целью оптимизации процесса гомогенизации было проведено исследование влияния основных технологических параметров на физические свойства (средний диаметр частиц по унимодальному распределению и светопропускание) получаемых эмульсий. В таблице 1 приведены результаты исследования характеристик полученных эмульсий.
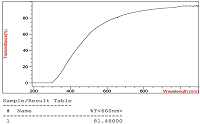
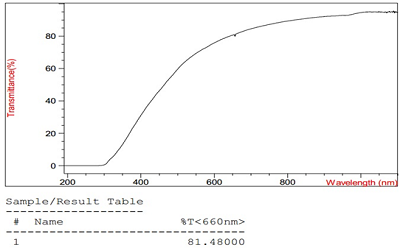
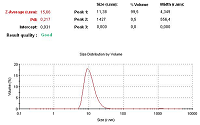
Проведение гомогенизации при высоких значениях давления (1000 атм и 1500 атм) и температуры (45°С и 55°С) с большим количеством циклов (5 и 7) способствовало получению однородных эмульсий, характеризующихся размером наночастиц менее 50 нм и светопропусканием не менее 60%. В условиях проведения трех циклов гомогенизации даже при максимально используемых значениях давления (1500 атм) и температуры (55°С) получаемые эмульсии обладали худшими характеристиками. Аналогичные результаты были получены под действием минимального прилагаемого давления 500 атм. Оптимальными параметрами процесса гомогенизации для получения эмульсии лекарственного средства, образованного растительным фосфатидилхолином и ЛПС, с размером частиц не более 50 нм и светопропусканием не ниже 60% были определены следующие условия: температура процесса 45°С, давление гомогенизации – 1000 атм и проведение 5 циклов гомогенизации. Изучение физико-химических свойств лекарственного средства Внутривенное введение разрабатываемого лекарственного средства предполагает детальное изучение его физико-химических характеристик, поэтому наряду с традиционными методами контроля качества (согласно Государственной Фармакопеи ХII) [25], необходимо использовать и разработанные специфические методы определения размера частиц в полученной эмульсии, процента включения липидного производного сарколизина в фосфолипидные наночастицы. Полученная эмульсия не должна содержать крупных частиц, захватываемых РЭС и способных также вызвать закупорку сосудов/капилляров, поэтому целесообразно изучение светопропускания и распределения частиц по размерам. На рисунке 3 представлены результаты одного из измерений светопропускания, а на рисунке 4 приведено типичное распределение частиц по размерам в ультратонкой эмульсии лекарственного средства.
Высокое значение светопропускания коррелировалось с размером частиц основной фракции. Измерения, проведённые в трёх одинаково приготовленных образцах, показали, что полученное лекарственное средство представляло собой высокогомогенный раствор с диаметром наночастиц 23.4 ± 2.17 нм и светопропусканием 82.0 ± 0.64%. Количественное определение фосфатидилхолина ферментно-колориметрическим методом показало, что его содержание в полученной суспензии составило 25.0 ± 0.90 мг/мл. Количество ЛПС в эмульсии в среднем составило 2.5 ± 0.052 мг/мл (по хромато-масс-спектрометрическому методу). На рисунке 5 показана хроматограмма одного из проведённых анализов.
Методом ультрафильтрации было установлено, что 99% ЛПС встроилось в фосфолипидные наночастицы, при этом содержание децилового конъюгата сарколизина в свободном виде составило 2.48 ± 0.053 мг/г. Следовательно, полученная модификация сарколизина в форме липидного производного с деканолом способна максимально встраиваться в фосфолипидные наночастицы. Известно, что в растворе липидные наночастицы склонны к агрегации, сопровождающейся увеличением гетерогенности в распределении частиц по размеру, поэтому в следующей серии опытов была изучена стабильность полученного лекарственного средства при хранении в растворе. В таблице 2 приведены основные характеристики эмульсии за различные промежутки времени с момента разведения при его хранении в течение 2 суток при комнатной температуре.
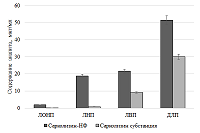
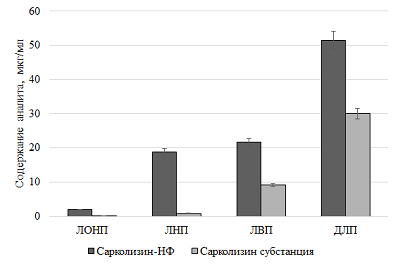
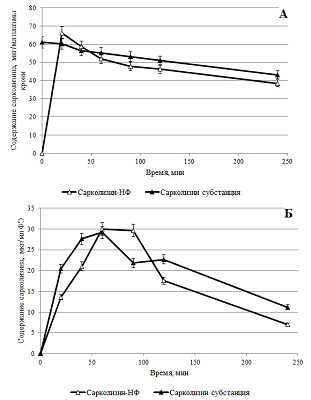
Динамика значений среднего диаметра частиц не превышала 50 нм, при этом индекс полидисперсности увеличивался незначительно, свидетельствуя о низкой скорости процесса агрегации, светопропускание оставалось на допустимом уровне (выше 60%). Таким образом, полученное лекарственное средство на основе ЛПС в составе фосфолипидных наночастиц представляло собой ультратонкую эмульсию, сохранявшей агрегационную устойчивость в водной среде как минимум в течение 2-х суток. Сравнительное исследование распределения сарколизина по компонентам плазмы Согласно ГОСТ Р 56702-2015 тщательное изучение распределения вещества необходимо для интерпретации данных фармакологических исследований, эта информация может быть полезна для планирования токсикологических и фармакологических исследований [26]. Взаимодействие лекарства с компонентами крови – плазмой крови и форменными элементами – может существенно влиять на его фармакологические свойства: метаболизм, распределение по тканям, проявление биологической активности и токсического действия [27-29]. На примере доксорубицина и индометацина было показано, что включение лекарства в наночастицы на основе фосфолипидов, изменяет его распределение по компонентам плазмы крови [30-31]. Перераспределение лекарства между компонентами крови способно оказывать существенное влияние на его фармакокинетику и накопление в ткани/органе мишени. Такой анализ особенно важен для препаратов, предназначенных для внутривенного введения, когда лекарство вводится непосредственно в кровоток. Известно, что распределение лекарственного соединения по компонентам плазмы 1) in vitro и in vivo одинаково и 2) в экспериментах in vitro в отсутствии взаимодействия лекарства с форменными элементами крови не зависит от того, происходит инкубация с кровью или с плазмой [32]. Поэтому сравнение распределения по компонентам плазмы сарколизина, введенного в составе фосфолипидных наночастиц, и в виде свободной субстанции проводили в экспериментах in vitro, инкубируя препараты с плазмой крови здорового донора (рис. 6).
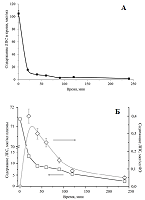
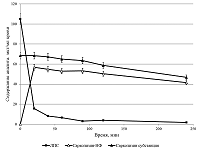
Из представленных данных видно, что 93.8% ЛПС обнаруживалось во фракциях липопротеинов плазмы крови (ЛОНП, ЛНП, ЛВП) и делипидированной фракции плазмы (ДЛП). При введении в плазму свободного сарколизина только 40% его обнаруживалось в липопротеинах и ДЛП. Остальные 60%, по-видимому, либо образовывали комплексы с иными структурами, чем липопротеины и белки плазмы, либо во время скоростного ультрацентрифугирования, будучи водонерастворимыми, оседали на дно. Исследование взаимодействия липидного производного сарколизина в составе фосфолипидных наночастиц с цельной кровью в экспериментах in vitro В работе [33] показано, что после внутривенного введения радиоактивного производного сарколизина мышам отмечено накопление лекарства в ФЭ крови. Для углубленного изучения механизма действия лекарственного средства было проведено сравнение взаимодействие сарколизина, введенного либо в виде разработанной лекарственной формы Сарколизин-НФ (ЛПС, включенное в фосфолипидные наночастицы), либо в виде свободной субстанции, взаимодействовать с клетками крови (форменными элементами). На рисунке 7 приведены результаты определения ЛПС в компонентах крови экспериментальных животных в зависимости от времени после введения в кровь Сарколизина-НФ.
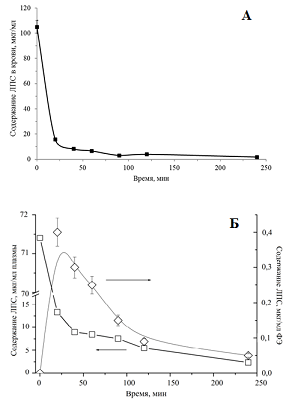
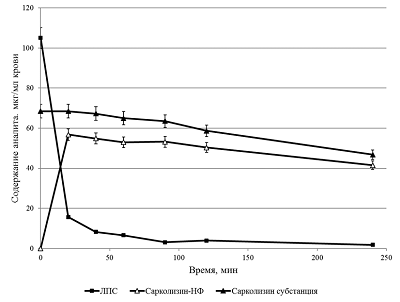
Содержание ЛПС в цельной крови резко падало уже после 20 мин инкубации и составляло около 15% от его исходной концентрации в образце. В дальнейшем содержание ЛПС в цельной крови продолжало медленно снижаться. Тенденция изменения содержания ЛПС в плазме была аналогичной. В форменных элементах сначала наблюдали рост содержания ЛПС (в максимуме содержание ЛПС составляло приблизительно 0.4% от исходной концентрации в образце), а затем наблюдали постепенное его снижение до 0.05%. Наблюдаемые изменения обусловлены гидролизом ЛПС под действием ферментов в клетках крови и его превращением из пролекарства в лекарство – сарколизин. На рисунке 8 наряду с кривой, изображающей кинетику снижения концентрации ЛПС в крови, приведены результаты изменения концентрации сарколизина в образцах цельной крови после добавления Сарколизина-НФ и свободной субстанции сарколизина.
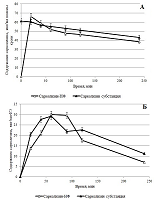
Из рисунка 8 видно, что содержание сарколизина через 20 мин инкубации после добавления как Сарколизина-НФ, так и субстанции сарколизина практически одинаковы. Представленные результаты свидетельствуют о том, что в крови ЛПС (пролекарство) превращается в исходное лекарство, механизм действия которого известен. Этот вывод подтверждается также практически синфазными изменениями сарколизина в плазме (рис. 9 А) и ФЭ крови (рис. 9 Б) как в образцах после добавления Сарколизина-НФ, так и в образцах после добавления субстанции сарколизина.
Результаты, представленные на рисунке 9, свидетельствуют о том, что независимо от того, в каком виде сарколизин – в составе фосфолипидных наночастиц с включенным пролекарством ЛПС или в свободном виде - был добавлен в цельную кровь, уже через 20 мин его содержание, как в цельной крови, так и в плазме и форменных элементах было одинаковым. ОБСУЖДЕНИЕ Для получения ультратонкой эмульсии лекарственного средства на основе ЛПС в составе фосфолипидных наночастиц необходимо использование следующих условий процесса гомогенизации: температура 45°С, давление – 1000 атм в течение 5 циклов. Полученная фармакологическая субстанция имела светопропускание выше 80%, размер частиц основной фракции (99.5%) составлял в диаметре 22.76 нм (при этом 99% ЛПС было встроено в фосфолипидные наночастицы). Эмульсия сохраняла агрегационную устойчивость в водной среде как минимум в течение 2-х суток. Результаты экспериментов in vitro показали, что распределение сарколизина по компонентам плазмы после инкубации в присутствии сарколизина в виде ЛПС, включенного в фосфолипидные наночастицы, и сарколизина в свободном виде существенно различались: 1) практически весь сарколизин, введенный в составе фосфолипидных наночастиц, был распределен по липопротеинам и белковым компонентам плазмы крови; 2) все фракции, тем или иным способом участвующие в транспорте биологически активных веществ в организме, содержали значительно больше сарколизина при введении в виде пролекарства ЛПС в составе фосфолипидных наночастиц, чем при введении свободного сарколизина в инкубационную среду. Наблюдаемое со временем уменьшение концентрации сарколизина в образцах крови и форменных элементов, по всей видимости, вызвано постепенным образованием комплексов лекарства с ДНК форменных элементов крови (в том числе с ДНК эритробластов), а также некоторый его объем может адсорбироваться эритроцитами. При введении в кровь ЛПС в составе фосфолипидных наночастиц в клетках форменных элементов (а не в плазме) пролекарство превращается в лекарство сарколизин, механизм действия которого, как алкилирующего агента, известен. Возможно, данное превращение обусловлено работой ферментной системы клеток крови. Таким образом, разработанная лекарственная композиция содержит известную по спектру фармакологической активности субстанцию сарколизина, которая модифицирована путем образования сложно-эфирной связи с деканолом, включенную в фосфолипидные наночастицы как систему транспорта. Полученные результаты имеют высокую практическую значимость и составляют основу для дальнейшего проведения доклинических исследований лекарственной композиции ЛПС в фосфолипидных наночастицах для лечения миеломной болезни и гемобластозов. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ При использовании консервированной плазмы крови человека соблюдены все требования этических принципов проведения медицинских исследований с участием человека в качестве субъекта - Хельсинкской декларацией Всемирной медицинской ассоциации, принятой на 18-ой Генеральной Ассамблее ВМА (Хельсинки, Финляндия, 1964 г.), с изменениями на 64-ой Генеральной Ассамблее ВМА (Форталеза, Бразилия, 2013 г.). Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке Минобрнауки РФ, в рамках Государственного контракта № 14.N08.11.1029 «Доклинические исследования лекарственного средства на основе липидного производного сарколизина в липосомальной форме для лечения миеломной болезни и гемобластозов». ЛИТЕРАТУРА
|